由于神经退行性疾病的复杂成因�����,目前临床上尚缺乏有效的治疗方案�����,甚至对疾病病理进程也未完全了解���。在研究 AD 的过程中����,最先引起科研学者们注意的相关蛋白是 β 淀粉样肽���,其出现在 AD 患者的大脑斑块中����,被认为是导致神经元变性甚至死亡的原因[2]���。因此最初的药物和治疗方案都是针对该蛋白���,但令人失望的是����,这些新药研发全军覆没����。于是国内外更多的研究重点又放在了 tau 蛋白上����。
不过���,随着越来越深入的研究����,科研学者们发现 AD 可能不是单纯由某一个蛋白致病���,而是两种蛋白同时出现问题共同导致的疾病进程[3]���,所以����,科研学者决定重新对 β 淀粉样肽开展研究�����。
从结构和机制上来说����,β 淀粉样肽简称 Aβ��,是淀粉样肽前体蛋白(APP)的水解产物����。APP 则是一种跨膜整合蛋白��,存在于多种组织当中���,尤其是在 AD 中有重要角色的神经元突触[4]��。APP 蛋白水解之后释放 Aβ����,而后聚集沉积���,是淀粉样斑块的主要成分��。Aβ 和 tau 蛋白以及 α 突触核蛋白都有类似的蛋白聚集机制��,从单体到寡聚体再到原纤维��,然后像种子一样诱导更多单体形成原纤维/聚集体�����。
从形式和特性上来说�����,Aβ 肽是单体����,主要有两种形式 Aβ40 和 Aβ42����,前者在正常老年人和 AD 患者脑中含量丰富���,而后者主要存在于 AD 患者脑中[5]����。Aβ42 非常不稳定且极其容易聚集����,导致研究它的各种结构(单体����、寡聚体���、原纤维)非常困难[6]����。由于 Aβ1-42 在水溶液中是无结构的����,而非极性溶剂可以诱导 α 螺旋结构[7]����,所以目前市面上常用的是 HFIP(1,1,1,3,3,3-六氟-2-丙醇����,一种非极性溶剂)处理的 Aβ 肽����,使之稳定于单体状态���。当 HFIP 中水的含量增加时���,α 螺旋开始变成 β 折叠[7]���,也就是聚集过程的开始���,因此 Aβ 单体在运输和储藏过程中是干粉状态�����,需要防潮���,避免水份的加入��。
StressMarq 的 β 淀粉样肽 1-42(Aβ42)为合成肽��,在干燥前用 HFIP 处理����,从而可以分解前体原纤维并使肽单体化���,一些文献中也使用该方法[8,9]�����。在 DMSO/dH2O 中重新悬浮后��,当在 TEM���、AFM 和具有抗 Aβ 抗体的蛋白质印迹下观察时����,Aβ42 呈现为不含原纤维的单体肽���。值得注意的是�����,与 Aβ42 寡聚体和原纤维相比����,Aβ42 单体对原代大鼠皮层神经元没有毒性����。
图 1. 从左至右分别为 Aβ 单体(SPR-485)���,寡聚体(SPR-488)和原纤维(SPR-487)的电镜图����。负染色透射电子显微镜图像在 80 Kv 下在碳涂层的 400 目铜网格上使用磷钨酸和乙酸双氧铀染色获得���。比例尺 = 100 nm���。
图 2. 从左至右分别为 Aβ 单体(SPR-485)��,寡聚体(SPR-488)和原纤维(SPR-487)的原子力显微镜图���。将 1.0 mg/mL 样品在 dH2O 中稀释至 0.1 mg/mL 置于新鲜切割的云母上�����,清洗����、干燥并以轻敲模式进行原子力显微镜分析��。上图为 2.5 x 2.5 µm x-y���,z 范围为 10 nm���。淀粉样斑块的出现一直被认为是 AD 疾病的象征���,但是它出现的数量和节奏都与 AD 疾病的进程不符��,所以近年来��,研究学者们发现推动疾病进程更多的可能是 Aβ 寡聚体和原纤维����。制作寡聚体和原纤维的步骤在很多文献都有描述[8~10]��,以下图表为常用的处理方法����:
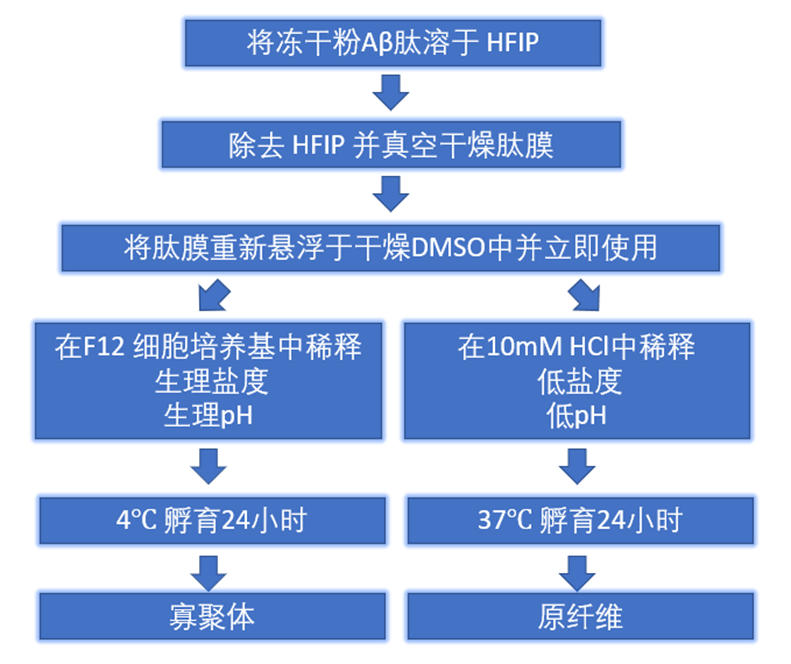
图 3. Aβ 寡聚体和原纤维制作流程[10]
StressMarq 的 Aβ42 寡聚体使用 Aβ 肽由特殊方法制得���,F12 细胞培养基方法也在投入生产��。Aβ42 寡聚体在电子显微镜(图 1)和原子力显微镜(图 2)下显示出明显的球状结构��,而在 WB(图 4)中使用抗 Aβ 抗体显示出独特的二聚体/三聚体和寡聚体信号��。同时 Aβ 寡聚体对原代大鼠皮质神经元有毒性(图 5)����。Aβ42 原纤维使用 Aβ 肽由 HCl 方法制得����,在电子显微镜(图 1)和原子力显微镜(图 2)下显示出明显的长链状结构���,而在 WB(图 4)中使用抗 Aβ 抗体显示出独特的高分子量信号���。同时 Aβ 原纤维对原代大鼠皮质神经元有毒性(图 5)���。
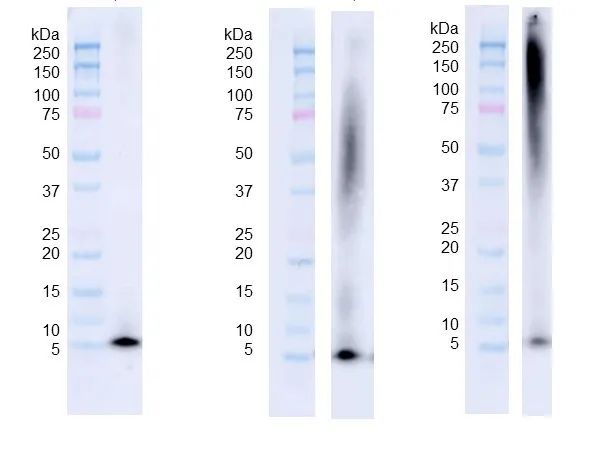
图 4. 从左至右分别是 Aβ 单体(SPR-485)���,寡聚体(SPR-488)和原纤维(SPR-487)的 WB���,抗体是抗 Aβ6E10 抗体���。三种 Aβ 蛋白(160 pmol)在 4%~12% Bis-Tris SDS-PAGE 上跑胶后���,在 0.02% v/v Tween-20 存在下转移到硝酸纤维素上��,并用 1:1000 小鼠 6E10 一抗做 WB����。在 TEM/AFM 下观察到的寡聚体显示出明显的二聚体/三聚体条带以及来自 ~37-75 kDa 的信号(中)����。在 TEM/AFM 下观察到的原纤维显示出大于 100 kDa 的信号���,并且在浓缩胶(右)中有明显的信号����。
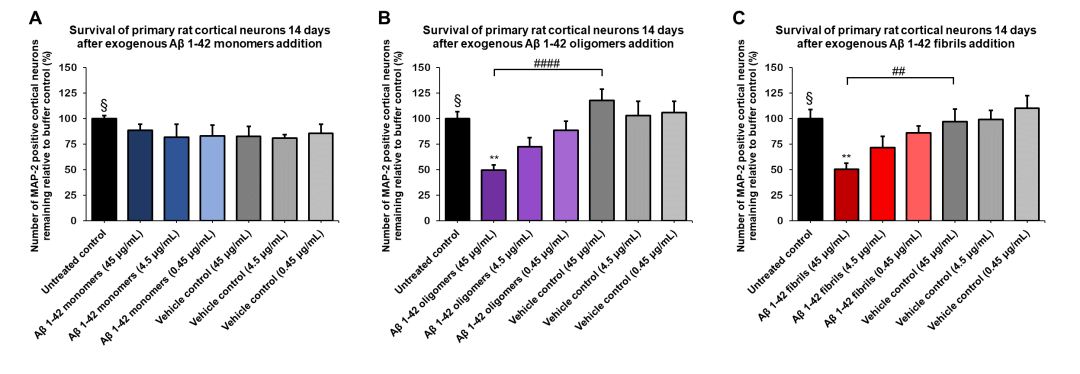
图 5. Aβ 1-42 寡聚体(SPR-488)和原纤维(SPR-487)对原代大鼠皮层神经元显示出剂量依赖性毒性����,但单体(SPR-485)没有毒性��。大鼠原代皮层神经元用不同浓度的(A)单体�����、(B)寡聚体或(C)原纤维处理 14 天后的存活率�����,由 MAP2 阳性神经元量化并表示为对照的百分比(空白对照设为 100%)���。原纤维和相应的载体对照先在 Bioruptor 超声破碎仪中进行超声处理����。测试条件在与未处理的对照和载体对照相同的板中运行���,由不含 Aβ 1-42 蛋白的缓冲液组成�����。数据表示为平均值 +/- s.e.m.(n = 6)���。使用单向方差分析和 Dunnett 检验对数据进行全局分析����;** p < 0.01 统计数据相比于对照���;## p < 0.01, # p < 0.0001 统计数据相比于载体对照��。§ 代表未经处理的对照条件����。
总的来说���,StressMarq 的 Aβ 单体�����、寡聚体和原纤维都可以应用于 WB��,以及体内和体外实验���。StressMarq 的 Aβ 寡聚体在毒性方面有潜力成为更好的建模工具���,更多数据或产品详情��,可联系一级代理商-欣博盛生物
参考文献��:
[1]. https://www.bjnews.com.cn/detail/160067807215569.html
[2]. Shankar, G.M. et al. Amyloid-b protein dimers isolated directly from Alzheimer’s brains impair synaptic plasticity and memory. Nat Med. 2008 Aug;14(8):837-42.
[3]. Eisenberg, D.S. and Sawaya, M.R. Structural Studies of Amyloid Proteins at the Molecular Level. Annu. Rev. Biochem. 2017. 86:69–95.
[4]. Chen, G.F. et al. Amyloid beta: structure, biology and structure-based therapeutic development. Acta Pharmacol Sin. 2017 Sep;38(9):1205-1235.
[5]. Qiao L, Sun Y, Qu Z. Research situation of tau proteins and β-amyloid protein in the pathological process and autophagic mechanisms in Alzheimer′s disease. Chin J Diagnostics(Electronic Edition), 2019,7(2): 94-97.
[6]. LeVatte,M.A. et al. Preparation and characterization of a highly soluble Aβ1-42 peptide variant. Protein Expr Purif. 2019 Dec;164:105480.
[7]. Zhang-Haagen, B. et al. Monomeric Amyloid Beta Peptide in Hexafluoroisopropanol Detected by Small Angle Neutron Scattering. PLoS One. 2016; 11(2): e0150267.
[8]. Stine et al. In Vitro Characterization of Conditions for Amyloid-β Peptide Oligomerization and Fibrillogenesis.2003. JBC. 278(13):11612-22.
[9]. Chromy et al. Self-Assembly of Aβ1-42 into Globular Neurotoxins. 2003. Biochemistry. 42:12749-12760.
[10]. Dahlgren, K.N.. et al. Oligomeric and Fibrillar Species of Amyloid-β Peptides Differentially Affect Neuronal Viability. J Biol Chem. 2002 Aug 30;277(35):32046-53.
全国服务热线: 4006-800-892 邮箱: market@hnyazd.com
深圳: 0755-26755892 北京: 010-88594029 上海: 021-34613729
广州��:020-87615159 香港: 852-69410778
代理品牌网站: www.hnyazd.com
自主品牌网站: www.neobiosescience.net